Badania odpowiedzi immunologicznej nanoszczepionek z tlenku grafenu
Badania odpowiedzi immunologicznej nanoszczepionek z tlenku grafenu
International Journal of Biomedical Engineering, 2018, 41(1) : 38-43. DOI: 10.3760/cma.j.issn.1673-4181.2018.01.006
Cel: Celem omawianych w niniejszym artykule badań było uzyskanie swoistych odpowiedzi immunologicznych indukowanych przez nanowszczepionki z tlenku grafenu (GO) u myszy.
Metody: Nanokompleksy tlenku grafenu (GO) obciążone (komórkami białkowymi) OVA (owoalbuminy – owalne albuminy - główne białko występujące w białku jaj - przyp. tłum.) przygotowano poprzez koinkubację GO z modelowym antygenem - owalbuminą (OVA). Nano-GO scharakteryzowano za pomocą mikroskopu sił atomowych i analizatora wielkości cząstek; cytotoksyczność nano-GO na mysie komórki dendrytyczne szpiku kostnego (BMDCs) wykryto za pomocą zestawu do liczenia komórek (CCK-8); wychwyt nanoimmunologicznego kompleksu GO-OVA przez mysie komórki dendrytyczne szpiku kostnego (BMDCs) obserwowano za pomocą barwienia fluorescencyjnego. Myszy C57BL/6 podzielono na grupę OVA, grupę OVA z adiuwantem aluminiowym (Al-OVA) i grupę GO-OVA (6 myszy w każdej grupie) zgodnie z metodą strefowej randomizacji masy ciała w celu immunizacji in vivo. Poziomy swoistych dla OVA przeciwciał IgG (całkowite IgG, IgG1 i IgG2a) w surowicy myszy mierzono testem immunoenzymatycznym (ELISA), zaś śledzionę i wątrobę badano metodą immunoenzymatyczną. Podsystemy limfocytów T w śledzionie i węzłach chłonnych pachwinowych myszy wykrywano metodą cytometrii przepływowej.
Wyniki: Średni rozmiar cząstek otrzymanych nanocząstek GO wynosił (294,34 ± 4,68) nm, a współczynnik polidyspersyjności 0,208. Toksyczność nanocząstek GO dla mysich komórki dendrytyczne szpiku kostnego (BMDCs) była niska. Testy komórkowe in vitro wykazały, że kompleksy nanoimmunologiczne GO-OVA były efektywnie pobierane przez mysie komórki dendrytyczne szpiku kostnego (BMDCs). Proporcje limfocytów CD4+ T i CD8+ T w śledzionie i węzłach chłonnych pachwinowych myszy w grupie myszy GO-OVA były znacząco wyższe niż w grupach myszy OVA i Al-OVA, natomiast wszystkie różnice były statystycznie istotne (P<0,05).
Wnioski: Kompleks nanoimmunologiczny GO-OVA indukował u myszy zarówno humoralną, jak i komórkową odpowiedź immunologiczną, co stanowi podstawę do opracowania nowych wektorów szczepionkowych i adiutantów.[1]
0. Wprowadzenie
W 2013 roku tumour immunotherapy została wymieniona jako jeden z dziesięciu przełomów technologicznych w międzynarodowym topowym czasopiśmie Science i jest nową strategią leczenia klinicznego nowotworów złośliwych w ostatnich latach[1]. Immunoterapia nowotworów opiera się na funkcji autoimmunologicznej w celu aktywacji układu odpornościowego organizmu do zabijania komórek nowotworowych[2]. Wraz z intensywnymi badaniami nad immunoterapią nowotworów, wiele uwagi poświęca się rozwojowi szczepionek przeciwnowotworowych[3,4,5]. Nowe szczepionki peptydowe opracowane przy użyciu nowoczesnej biotechnologii są zwykle słabo immunogenne i wymagają zastosowania odpowiedniego wektora szczepionkowego lub adiuwanta. Obecnie stosowane klinicznie adiuwanty, takie jak adiuwanty glinowe, aktywują głównie humoralną odpowiedź immunologiczną, ale nie odporność komórkową, co stanowi wąskie gardło w rozwoju większości nowych szczepionek peptydowych.[6,7]
Tlenek grafenu (GO) jest nowym, jednowarstwowym, dwuwymiarowym nanomateriałem węglowym z dużą liczbą grup funkcyjnych zawierających tlen, takich jak grupy karboksylowe, hydroksylowe, karbonylowe i epoksydowe przyłączone do jego powierzchni, który charakteryzuje się dobrą adsorpcją i biokompatybilnością, wykazując tym samym obiecujące zastosowania w dziedzinie dostarczania leków.[8,9,10] W niniejszej pracy omówiono przygotowane do badań nanokompleksy GO obciążone OVA z modelowym antygenem - owalbuminą (OVA), a następnie wstępnie zbadano i oceniono odpowiedzi immunologiczne indukowane u myszy.
1. Materiały i metody
1.1. Główne materiały i aparatura
Tlenek grafenu GO (dostarczony przez pana Shi Jiafu z Uniwersytetu w Tianjin), OVA (czystość >99%) (Sigma-Aldrich, USA), zestaw do enzymatycznego testu immunosorbcyjnego (ELISA) z mysią IgG, allofykocyjanina (APC) ludzkim przeciwciałem monoklonalnym antymysim CD3e, ludzkim przeciwciałem monoklonalnym antymysim CD4 znakowanym izotiocyjanianem fluoresceiny (FITC), kompleksem perydyna-chlorofil-białko, PerCP)-Cy5.5-wybarwionym mysim przeciwciałem, monoklonalnym antymysim CD8a (eBioscience, USA), zestawem do liczenia komórek-8 (CCK-8) (Tong Ren Chemical Research Institute, Japonia), 4',6-diamidino-2-fenyloindol (DAPI), 4',6-diamidino-2 phenylindole, DAPI), Lyso Tracker-Red (Shanghai Biyuntian Biotechnology Co., Ltd.) i lizosomalną czerwoną sondą fluorescencyjną. Dziewiętnaście zdrowych, wolnych od patogenów, 6-tygodniowych samic myszy C57BL/6, o masie ciała 17~19 g, zakupiono od Beijing Huafukang Biotechnology Co.
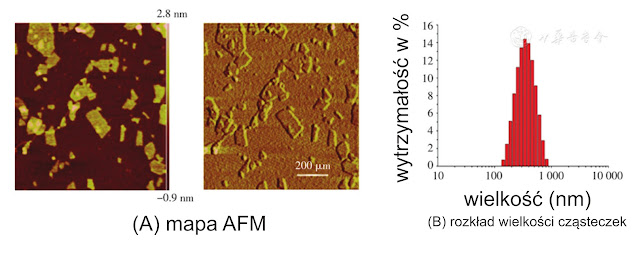
Ponadto wykorzystano: analizator wielkości cząstek Nano-ZS90 (Malvern Instruments Ltd., UK), wielofunkcyjny etykieciarka enzymów Varioskan Flash 3001 o pełnej długości fali (Thermo Fisher Scientific, USA), cytometr przepływowy BD Accuri C6 (BD, USA), mikroskop sił atomowych Multi-mode 8 ( Veeco, USA), przerywacz ultradźwiękowy VCX130PB (Sonics & Materials, USA), ultrawirówka Optima L-100XP (Beckman, USA), laserowy skaningowy mikroskop konfokalny LSM710 (Carl Zeiss, Niemcy).
1.2. Metody
1.2.1. Przygotowanie i charakterystyka nano-GO
Wodne roztwory GO o stężeniu masowym 1 mg/ml poddawano sonikacji (30 kW, 0,5 h) w kruszarce ultradźwiękowej, a nano-GO zbierano przez odwirowanie, liofilizowano i odkładano na bok. Morfologię powierzchni nano-GO obserwowano za pomocą mikroskopu sił atomowych, a wielkość cząstek i ich rozkład określano za pomocą analizatora wielkości cząstek.
1.2.2. Przygotowanie kompleksów nanoimmunologicznych GO-OVA
0,5 ml nanokompleksu GO o stężeniu masowym 0,2 mg/ml [sól fizjologiczna buforowana fosforanami (PBS), pH 7,4] zmieszano z 0,5 ml roztworu OVA (PBS, pH 7,4) o stężeniu masowym 0,4 mg/ml i inkubowano w temperaturze pokojowej przez 0,5 h. Roztwór odwirowano przy 2000 x g przez 10 min. Zawartość OVA w odwirowanym supernatancie zmierzono metodą kwasu bis(chinolinowego) (BCA) i obliczono ładunek OVA. Podobnie, OVA znakowana FITC została użyta do przygotowania kompleksów nanoimmunologicznych GO-OVA znakowanych FITC.
1.2.3. Ocena cytotoksyczności nano-GO
(i) Izolacja i hodowla komórek dendrytycznych szpiku kostnego myszy:
Myszy C57BL/6 były trzymane w wolnym od patogenów domu dla zwierząt w temperaturze 18~29 ℃ i wilgotności względnej 40%~70%, z naprzemiennym dniem i nocą światła i ciemności 12 h/12 h, i swobodny dostęp do żywności i wody. Jedną zdrową, 6-tygodniową samicę myszy C57BL/6 uśmiercono przez dekortykację, a następnie wysterylizowano przez zanurzenie w roztworze 75% objętościowo etanolu na 2 minuty; kość udową szybko przeniesiono na płytkę Petriego zawierającą podłoże RPMI-1640 i pocięto na odcinki; szpik kostny wydmuchano z jamy szpikowej przez aspirację podłoża RPMI-1640 za pomocą strzykawki, wielokrotnie przedmuchano, a następnie przepuszczono przez filtr 200 Przesącz przenoszono do probówki wirówkowej i wirowano przy 450 x g przez 5 min; supernatant odrzucano, a następnie dodawano 2 ml lizatu krwinek czerwonych w celu resuspensji komórek przez 2 min; lizat rozcieńczano przez dodanie podłoża RPMI-1640 i ponownie wirowano przy 450 x g przez 5 min; supernatant odrzucano, a osad stanowiły komórki dendrytyczne pochodzące ze szpiku kostnego (BMDC). BMDC były resuspended przez dodanie kompletnej pożywki RPMI-1640 (zawierającej 10% objętości płodowej surowicy bydlęcej, 20 ng/ml mysiego czynnika stymulującego kolonie granulocytów-makrofagów, 10 ng/ml mysiej interleukiny-4, 100 μg/ml streptomycyny i 100 IU/ml penicyliny). Komórki zaszczepiano w szalkach hodowlanych i inkubowano w temperaturze 37°C w inkubatorze z 5% CO2.
(ii) Badanie cytotoksyczności CCK-8:
Hodowane przez 7 dni mysie BMDCs inokulowano na płytki 96-dołkowe w gęstości 1×105 komórek/dołek i inkubowano przez noc w temperaturze 37°C w inkubatorze z 5% CO2.
1.2.4. Badanie absorpcji komórkowej kompleksów nanoimmunologicznych GO-OVA
Myszy BMDCs inokulowano w gęstości 1×105 komórek/basenik w laserowej konfokalnej szalce do hodowli komórkowych i inkubowano przez 24 h w temperaturze 37 °C w inkubatorze z 5% CO2.
1.2.5. Ocena immunologiczna in vivo
Pozostałe zdrowe 6-tygodniowe samice myszy C57BL/6 podzielono na grupę OVA, grupę OVA z adiuwantem aluminiowym (Al-OVA) i grupę GO-OVA z kompleksem nanoimmunologicznym (GO-OVA), zgodnie z randomizacją masy ciała, po 6 myszy w każdej grupie. Myszy immunizowano wolną OVA, Al-OVA i nano-kompleksami GO-OVA poprzez wstrzyknięcie podskórne odpowiednio w dniach 0, 7 i 14, a dawka OVA wynosiła 100 μg na mysz. Krew pobrano z oczodołów myszy w każdej grupie 7 dni po ostatniej immunizacji, a surowicę odwirowano i oddzielono w celu określenia poziomu swoistych dla OVA przeciwciał IgG (całkowita IgG, IgG1 i IgG2a) w surowicy przy użyciu zestawu ELISA IgG myszy. W tym samym czasie trzy myszy z każdej grupy były losowo wybierane do wykrywania subpopulacji limfocytów T w lokalnych węzłach chłonnych i śledzionie.
(A) Test ELISA na wykrywanie przeciwciał swoistych dla OVA w surowicy
Metoda jest następująca11,12: 96-dołkowe płytki są pokryte roztworem OVA (PBS, pH 7,4) o stężeniu masowym 20 μg/ml i inkubowane przez noc w temperaturze 4 ℃; roztwór albuminy surowicy bydlęcej (PBS, pH 7,4) o stężeniu masowym 100 g/L jest dodawany i zamykany na 2 godziny; bufor fosforanowy Tween jest prawidłowo płukany, dodawana jest rozcieńczona surowica, która ma być badana i inkubowana w temperaturze 37 ℃ przez 2 godziny; bufor fosforanowy bufor Tween, dodano znakowaną biotyną szczurzą anty-mysią IgG rozcieńczoną odpowiednio w roztworze blokującym i inkubowano przez 1 godzinę w temperaturze 37 ℃; dodając substrat 3,3',5,5'-tetrametylobenzydyny do wywoływania koloru (50 μl na studzienkę), chroniono reakcję przed światłem w temperaturze 37 ℃ i monitorowano reakcję wywoływania koloru w czasie rzeczywistym (15-30 minut); dodano 1 mol/L roztwór kwasu siarkowego (50 μl na studzienkę), aby zakończyć reakcję i marker enzymatyczny. Absorbancja każdego dołka została zmierzona przy 450 nm. Specyficzne podtypy przeciwciał w surowicy zostały wykryte w sposób opisany powyżej, a dodane przeciwciała drugorzędowe były znakowane biotyną odpowiednio szczurzymi antymysimi IgG1 i IgG2a.
(iii) Wykrywanie podzbiorów limfocytów T
Węzły chłonne pachwinowe każdej grupy myszy zostały wyizolowane, a zawiesinę pojedynczych komórek przygotowano przez rozdrobnienie z odpowiednią ilością soli fizjologicznej. 1×106 komórek zebrano do 1,5 ml probówki wirówkowej i odwirowywano przy 450×g przez 5 min; supernatant odrzucono, a następnie dodano odpowiednio: ludzkie przeciwciało monoklonalne antymysie CD3e znakowane APC, ludzkie przeciwciało monoklonalne antymysie CD4 znakowane FITC, mysie przeciwciało monoklonalne CD8a znakowane PerCP-Cy5,5 oraz mysie przeciwciało monoklonalne CD8a znakowane PerCP-Cy5,5. Komórki inkubowano przez 30 min w temperaturze 4 ℃ w lodówce chronionej przed światłem; przemyto dwukrotnie PBS i odwirowywano przy 450×g przez 5 min za każdym razem, a supernatant odrzucono; na koniec dodano 0,4 ml PBS, aby ponownie zawiesić komórki i przeanalizować je za pomocą cytometrii przepływowej. Śledziona każdej grupy myszy była izolowana, krojona i reszta czynności była wykonywana jak wyżej.
1.3. Metody statystyczne
Do obróbki danych użyto oprogramowania statystycznego GraphPad Prism 5.0, zaś dane pomiarowe, zgodne z rozkładem normalnym, wyrażono jako średnią ± z odchyleniem standardowym (±s), natomiast test Tukeya został użyty po jednokierunkowej ANOVA do porównania wielu grup, zaś przy P<0,05 różnicę uznano za statystycznie istotną .
2. Wyniki i dyskusja
2.1. Charakterystyka nano-kompleksów immunologicznych GO-OVA i nano-GO
Jak pokazano na rysunku 1, nano-GO przygotowane przez rozdrobnienie ultradźwiękowe miało strukturę nano-monowarstwową pod AFM, a średnia wielkość cząstek nano-GO została zmierzona analizatorem wielkości cząstek jako (294.34±4.68) nm ze współczynnikiem polidyspersyjności 0.208. Tymczasem, ładunek OVA w kompleksach nano-immunologicznych GO-OVA został zmierzony jako 100% metodą BCA.
2.2. Badanie cytotoksyczności nanoGO
Cytotoksyczność nanoGO na mysie BMDCs mierzono metodą CCK-8. Wyniki wykazały, że toksyczny wpływ nanoGO na mysie BMDCs był zależny od stężenia, a cytotoksyczność wzrastała wraz ze wzrostem stężenia masowego nanoGO. Kiedy stężenie masowe nanoGO wynosiło 10 μg/ml, wskaźnik przeżywalności komórek mysich BMDCs był nadal wyższy niż 85%, więc stężenie masowe nanoGO stosowane w kolejnych eksperymentach komórkowych wynosiło 10 μg/ml.(Rysunek 2)
Rysunek 2: Zestaw do zliczania komórek do wykrywania toksyczności nanocząstek tlenku grafenu na komórki dendrytyczne szpiku kostnego myszy.
2.3. Badania absorpcji komórkowej kompleksów nanoimmunologicznych GO-OVA
Pobór nanoimmunizowanych kompleksów GO-OVA przez mysie BMDCs obserwowano przy użyciu laserowej skaningowej mikroskopii konfokalnej. Stwierdzono, że znakowana FITC OVA częściowo pokrywała się z lizosomami po wprowadzeniu nanoimmunizowanych kompleksów GO-OVA do mysich BMDCs, podczas gdy niewielka ilość znakowanej FITC OVA była również rozprowadzana w cytoplazmie i następowała ucieczka z lizosomów. (rys. 3)
Rysunek 3: Laserowa skaningowa mikroskopia konfokalna wychwytu nanokompleksów tlenku grafenu z owalbuminą przez komórki dendrytyczne szpiku kostnego myszy (barwienie fluorescencyjne).
2.4. Swoista odpowiedź przeciwciał na OVA
Wyniki testu ELISA wykazały, że chociaż poziom całkowitych IgG przeciwciał swoistych dla OVA w surowicy był wyższy w grupach Al-OVA i GO-OVA niż w grupie OVA, różnica między trzema grupami nie była statystycznie istotna (P>0,05) (rysunek 4A). rozkład podtypów IgG przeciwciał swoistych dla OVA może sugerować produkowane podtypy komórek T pomocniczych (Th), z Przeciwciała IgG1 związane są z odpowiedzią typu Th2, podczas gdy przeciwciała IgG2a związane są z odpowiedzią typu Th1 [13,14]. W tym badaniu, w porównaniu z grupą Al-OVA, poziom przeciwciał IgG1 specyficznych dla OVA w surowicy nie był podwyższony w grupie myszy GO-OVA, a różnica nie była statystycznie istotna (P>0,05) (rysunek 4B), podczas gdy poziom IgG2a był podwyższony, a różnica była statystycznie istotna (P<0,05) (rysunek 4C), wskazując, że humoralne przeciwciała IgG2a były podwyższone w grupie myszy GO-OVA. odpowiedź immunologiczna była zdominowana przez odpowiedź typu Th1.
Rysunek 4: Porównanie poziomów całkowitych IgG, IgG1 i IgG2a przeciwciał swoistych dla OVA w surowicach myszy z różnych grup.
2.5. Pomiar limfocytów T w śledzionie
Limfocyty T są kluczowymi komórkami w odporności komórkowej, gdzie limfocyty CD8+ T mogą bezpośrednio zabijać komórki docelowe, a limfocyty CD4+ T mogą wydzielać specyficzne cytokiny, które odgrywają drugorzędną rolę we wzmacnianiu odpowiedzi limfocytów CD8+ T [15,16]. Wpływ kompleksu nanoimmunologicznego GO-OVA na proliferację limfocytów śledziony myszy w tym badaniu przedstawiono na rysunku 5. W porównaniu z grupami OVA i Al-OVA, kompleks nanoimmunologiczny GO-OVA promował efektywną proliferację limfocytów CD4+ T i CD8+ T w śledzionie myszy, a różnice były statystycznie istotne (grupa GO-OVA w porównaniu z grupą OVA, obie P<0,01; grupa GO-OVA w porównaniu z grupą Al-OVA, obie P<0,05).

Rysunek 5: Porównanie subpopulacji limfocytów T śledziony w różnych grupach myszy.
2.6. Pomiar limfocytów T w pachwinowych węzłach chłonnych
Wpływ kompleksu nanoimmunologicznego GO-OVA na proliferację limfocytów T w pachwinowych węzłach chłonnych myszy przedstawiono na rycinie 6. W porównaniu z grupami OVA i Al-OVA, kompleks nanoimmunologiczny GO-OVA promował efektywną proliferację limfocytów CD4+ T i CD8+ T w pachwinowych węzłach chłonnych myszy, a różnice były statystycznie istotne (wszystkie P<0,05).
Rysunek 6: Porównanie podzbiorów limfocytów T w węzłach chłonnych pachwinowych pomiędzy grupami myszy.
3. Wnioski
Podsumowując, kompleks nanoimmunologiczny GO-OVA otrzymano poprzez współmieszanie nanocząstek GO z modelowym antygenem OVA w temperaturze pokojowej, a proces przygotowania był prosty i łatwy. Zdolność kompleksów nanoimmunologicznych GO-OVA do indukowania zarówno humoralnej, jak i komórkowej odpowiedzi immunologicznej u myszy stanowi podstawę do opracowania nowych wektorów szczepionek i adiuwantów.
Konflikt interesów:
Brak.
[1] adiuwant - substancja powodująca wzmocnienie poszczepiennej odpowiedzi odpornościowej na podany antygen. Adiuwanty stosowane są zarówno w badaniach naukowych, jak i w medycynie, na przykład w celu zwiększenia skuteczności szczepionek. Idealny adiuwant nie powinien wywoływać odpowiedzi swoistej względem siebie. Termin adiuwant został wprowadzony w 1926 roku przez Gastona Ramona.
Mechanizm działania adiuwantów, ze względu na ich różny charakter chemiczny, nie jest ściśle określony, wydaje się natomiast, że jedną z głównych ich właściwości jest spowolnienie uwalniania antygenu. Według teorii niebezpieczeństwa adiuwanty mogą także dostarczać sygnału niebezpieczeństwa, dzięki czemu nawet antygeny, względem których odpowiedź odpornościowa normalnie nie zachodzi, mogą zostać „zauważone” przez układ odpornościowy.
W ogólności adiuwanty można podzielić na adiuwanty pochodzenia bakteryjnego (przykładowo kompletny adiuwant Freunda, lipid A, dipeptyd muramylowy, endotoksyna) oraz niebakteryjnego (wodorotlenek glinu, fosforan glinu, fosforan wapnia, witamina A, ISCOM, MF-59, liposomy).










Komentarze
Prześlij komentarz